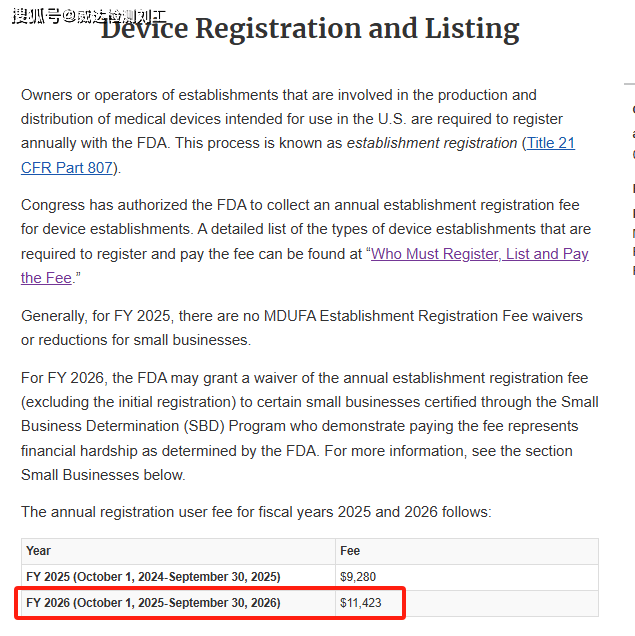
2026年美国FDA医疗器械企业年费 USD11423
2025年7月30日,FDA公布2026年美国FDA医疗器械企业年费,2026年企业年费为为USD11423, 较2025年USD9280, 增涨了USD 2143, 上涨了23%。无形中增加了中国企业进入美国市场的成本, 提高了中国企业进入美国市场的门槛。
医疗器械FDA注册:
注册核心流程
医疗器械FDA注册需遵循以下步骤,确保产品合规进入美国市场:
确定产品分类
FDA将医疗器械分为三类,风险等级逐级递增:
I类:低风险(如绷带、牙刷),通常豁免510(k),需完成企业注册和产品列名。
II类:中等风险(如血糖仪、超声设备),需提交510(k)申请,证明与已上市器械实质等同。
III类:高风险(如心脏起搏器、人工关节),需通过PMA(上市前批准),提交临床试验数据及设计验证文件。
选择上市前递交路径
510(k):适用于II类器械,需提供技术文件、性能测试报告及对比分析。
PMA:适用于III类器械,需提交科学证据证明安全性和有效性。
De Novo:针对无对比的新器械,若满足标准可分类为I或II类。
注册核心条件
企业需满足以下条件以确保注册成功:
合法运营主体
申请企业必须为合法运营实体,持有有效营业执照或注册证明。
境外企业需指定美国本土注册公司作为代理,承担FDA事务协调责任。
质量管理体系
建立符合ISO 13485或FDA QSR(质量系统规范)的质量管理体系,涵盖质量控制、记录管理及追溯能力。
生产设施需通过FDA现场检查,确保卫生条件、设备工艺及生产流程符合标准。
产品合规性
产品需全面符合FDA法规要求,包括成分安全性、生产工艺合理性、标签规范性及包装适用性。
标签和说明书需清晰、准确、完整,符合FDA规范。
技术文件完整性
提交完整的技术文件,包括设计原理、工艺流程图、风险分析报告及测试数据。
III类器械需提供临床试验证据,证明安全性和有效性。
注册费用概览
费用因申请类型和器械类别而异,主要费用包括:
1.企业年费:每年不同,2025年USD9280
2.510(k)申请费用:
a,标准费用:约$12,432(2024年数据)。
b,小型企业(年收入少于1,000,000)可申请减免,费用减半至6,216。
3.PMA申请费用
标准费用:约$387,089(2024年数据)。
小型企业可申请减免,费用减半至$193,545。
4.其他费用
前审程序费用:约$5,026(如请求前审程序)。
临床试验费用:若FDA要求进行临床试验,费用可能显著增加。
第三方检测费用:若需第三方检测机构进行性能测试,费用不等。
代理服务费用:若选择聘请注册顾问或代理机构不同而不同
注册周期与有效期
注册周期
I类豁免510(k)器械:1-2周内完成注册。
II类器械:约6个月至1年。
III类器械:可能超过1年,甚至数年。
注册有效期
医疗器械FDA注册有效期通常为一年,以每年10月1日为界。
10月1日之前办理的注册,需在当年10月至12月内完成缴费续签;10月1日之后办理的注册,需在下一年的10月至12月内完成缴费续签。
若到期未缴费,注册将失效。
